INTRODUCCIÓN
Este trabajo fue hecho con el objetivo de informar, describir o enseñar a los espectadores sobre el tema de los ácidos carboxílicos sus propiedades físicas químicas los usos que estos pueden recibir sus beneficios y riegos añadiremos imágenes alusivas para hacer mas ludico el aprendizaje espero les guste y puedan aprender.
¿QUE ES UN ÁCIDO CARBOXÍLICO ?
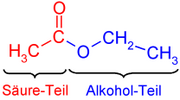
Es una función de carbono primario. Se caracteriza por tener en el mismo carbono el grupo carbonilo y un oxhidrilo. Se nombran anteponiendo la palabra ácido y con el sufijo oico. Algunos de ellos son más conocidos por sus nombres comunes como el ácido fórmico (metanoico) y ácido acético (etanoico).


ESTRUCTURA Y ESTADO NATURAL
De los compuestos orgánicos que presentan acidez apreciable, los ácidos carboxílicos son, los más importantes. Estas substancias con tienen el grupo carboxilo.
Si esta unido a un grupo alquilo (RCOOH), o a un grupo arilo (ArCOOH), o que se trate de un grupo alifático o aromático, saturado o no saturado, substituido o no, las propiedades del grupo carboxiloson esencialmente las mismas.
Algunos se hallan en las picaduras de los insectos como el metanoico (hormigas), otros en aceites y grasas y los superiores en las ceras.
PROPIEDADES FÍSICAS DE LOS ÁCIDOS CARBOXILICOS
Sus estructuras hacen suponer que los ácidos carboxílicos sean moléculas polares y , tal como los alcoholes, pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas. Los ácidos carboxílicos se comportan en forma similar a los alcoholes en cuanto a sus solubilidades : los primeros cuatro son miscibles con agua, el ácido de cinco carbonos es parcialmente soluble y los superiores son virtualmente insolubles. La solubilidad en agua se debe a los puentes de hidrógeno entre el ácido carboxílico y el agua. El ácido aromático más simple, el benzoico, contiene demasiados átomos de carbono como para tener una solubilidad apreciable en agua.
Los ácidos carboxílicos son solubles en solventes menos polares, tales como éter, alcohol, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más altas que los alcoholes. Estos puntos de ebullición tan elevados se deben a que un par de moléculas del ácido carboxílico se mantienen unidas no por un puente de hidrógeno sino por dos.
Las sales de sodio y potasio de la mayoría de los ácidos carboxílicos son fácilmente solubles en agua. Es el caso de ácidos carboxilicos de cadena larga. Estas sales son los principales ingredientes del jabón.
Debido a la fácil interconversión de ácidos y sus sales, este comportamiento puede emplearse de dos modos importantes: para identificación y para separación.
PROPIEDADES QUÍMICAS DE LOS ÁCIDOS CARBOXILICOS
El comportamiento químico de los ácidos carboxílicos esta determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.

REACCIÓN DE HUNSDIECKER
En ciertas condiciones los ácidos carboxílicos experimentan descarboxilación, es decir, perdida de dióxido de carbono, para formar un producto que tiene un átomo de carbono menos que el ácido inicial. En la reacción de Hunsdiecker, que implica el calentamiento de la sal de un metal pesado del ácido carboxílico con bromo o con yodo, se pierde dióxido de carbono y se forma un halogenuro de alquilo con un átomo de carbono menos que el ácido inicial. El ion metálico puede ser plata, mercurio II o plomo IV, todos funcionan igualmente bien.
HgO, Br2, CCl4
CH3(CH2)15CH2COOH CH3(CH2)15CH2Br + CO2
Ácido octadecanoico 1-bromoheptadecano
Reducción de Ácidos Carboxílicos.
Los ácidos carboxílicos son reducidos por hidruros fuertes, como el hidruro de litio y aluminio, para formar alcoholes primarios. Sin embargo, la reacción es difícil, y con frecuencia se requiere calentamiento en tetrahidrofurano como solvente para que se complete.
USOS O APLICACIONES DE LOS ÁCIDOS CARBOXILICOS
Se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, también para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
BENEFICIOS Y RIESGOS DE LOS ÁCIDOS CARBOXILICOS
El Ácido Metanoico o Formico es el veneno de las hormigas
El Acido Butanoico o Butirico es propio de las mantequillas y le confiere ese sabor.
El Ácido Etanoico o acetico es el bendito vinagre ni que decir mas.
El Acido Propanoico o Propionico es fermentador.
Ácido Pentanoico o Ácido Valerianico es la sustancia activa de la valeriana que es buena medicina para los nervios.
El Ácido Tricarboxilico es la Vitamina C.
La alimentación es una fuente importante de ácidos grasos. Esta contribución es vital para mantener un nivel de lipidos estable y para suministrar al cuerpo los ácidos grasos esenciales . Los ácidos grasos calificados de esenciales incluyen los omega 3 y omega 6. El cuerpo humano no puede sintetizarlos, o los sintetiza en cantidades insuficientes, es necesaria por tanto una contribución mínima y regular por medio de la alimentación.
Actualmente, según la AFSSA, la dieta proporciona suficiente omega 6 y muy poco omega 3
con una relación omega-6/omega 3 insuficiente.
Sin embargo, numerosos estudios han demostrado que el exceso de ácidos grasos (especialmente saturadas e instaurados trans) podría tener consecuencias para la salud, incluido el aumento de forma significativa del riesgo de problemas cardiovasculares .
Algunos estudios se centran en el consumo excesivo de grasas insaturadas trans procedentes de los procesos industriales como la hidrogenación parcial de los ácidos grasos de origen vegetal (aceites).
BIBLIOGRÁFIA
http://es.wikipedia.org/wiki/%C3%81cido_carbox%C3%ADlico
http://www.educatina.com/quimica-organica/acidos-carboxilicos-2?gclid=CKjN4rT7rLkCFcdr7AodJGQAfA
http://html.rincondelvago.com/acidos-carboxilicos_4.html






















.png&container=blogger&gadget=a&rewriteMime=image%2F*)


.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)



.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)